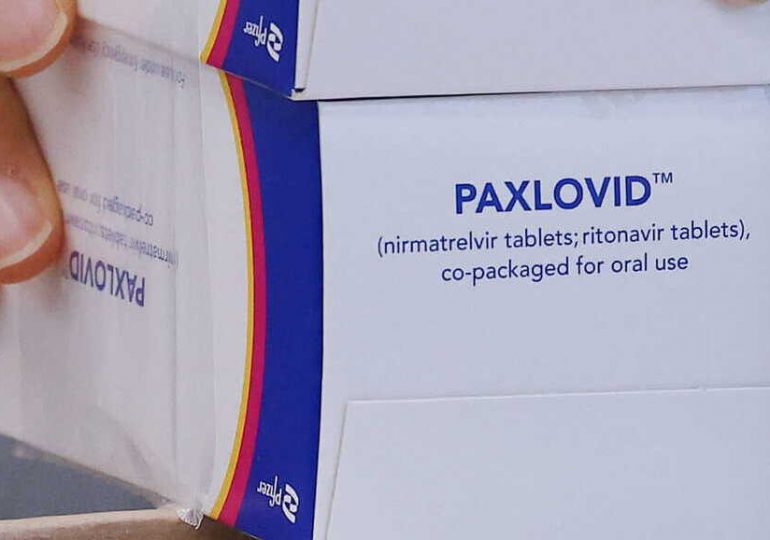
L’Agence européenne des médicaments (EMA) a annoncé jeudi 27 janvier avoir approuvé la pilule anti-Covid du fabricant Pfizer, commercialisée sous le nom de Paxlovid et qui doit devenir le premier traitement antiviral oral contre la maladie autorisé dans l’Union européenne.
« Paxlovid est le premier médicament antiviral à administrer par voie orale qui est recommandé dans l’UE pour traiter la Covid-19 », a déclaré l’EMA dans un communiqué.
Réduction des décès
Des études ont indiqué qu’il réduit significativement les hospitalisations ou les décès chez les patients risquant de développer une forme grave de la maladie, et devrait rester efficace contre le variant Omicron.
Les antiviraux agissent en diminuant la capacité d’un virus à se répliquer, freinant ainsi la maladie.
Ce type de comprimés pourraient potentiellement marquer un pas vers la fin de la pandémie car faciles à administrer : ils peuvent être pris chez soi avec un verre d’eau.
Le régulateur a recommandé « d’autoriser Paxlovid pour le traitement de la Covid-19 chez les adultes qui n’ont pas besoin d’oxygène supplémentaire et qui présentent un risque accru que la maladie devienne grave ».
La pilule Pfizer est une combinaison d’une nouvelle molécule, PF-07321332, et du ritonavir, un antiviral contre le VIH, qui se prennent sous forme de comprimés séparés.
Les États-Unis, le Canada et Israël font partie de la poignée de pays ayant déjà donné leur feu vert à cette pilule anti-Covid de Pfizer.
Les experts de l’EMA se sont penchés sur une étude « montrant que le traitement par Paxlovid réduisait de manière significative les hospitalisations ou les décès chez les patients qui avaient au moins une affection sous-jacente les exposant à un risque de la Covid-19 sévère ».
A administrer dans les cinq jours suivant les premiers symptômes
La pilule a été administrée à des patients dans les cinq jours suivant l’apparition des symptômes et au cours du mois suivant, seulement 0,8% des 1 039 personnes étudiées se sont retrouvées à l’hôpital, contre 6,3% chez celles ayant reçu un placebo.
Il n’y a eu aucun décès dans le groupe ayant reçu Paxlovid et neuf décès dans le groupe placebo, a indiqué l’EMA.
« Le comité des médicaments à usage humain de l’EMA a conclu que les bénéfices du médicament sont supérieurs à ses risques pour l’utilisation approuvée » et va « maintenant envoyer ses recommandations à la Commission européenne pour une décision rapide applicable dans tous les États membres de l’UE ».
L’approbation par la Commission prend généralement quelques heures à quelques jours.
« Paxlovid est le premier antiviral oral à usage domestique de notre portefeuille et a le potentiel de faire une réelle différence pour les personnes à haut risque de progression vers une forme de Covid sévère »
Communiqué de la commissaire européenne à la Santé et à la Sécurité alimentaire, Stella Kyriakides

L’EMA avait déjà approuvé en décembre l’utilisation en cas d’urgence de Paxlovid, en soutien aux autorités nationales, qui pouvaient décider d’une éventuelle utilisation précoce du médicament.
Le régulateur évalue toujours une demande similaire pour la pilule anti-Covid du fabricant américain de médicaments Merck.
Laisser un commentaire